Химические реакции связаны с разрывом химической связи.
Выделяют три основных типа реагирующих частиц – свободных радикал, нуклеофил и электрофил. Поэтому рассматривают классификацию реакций по типу реагирующих частиц:
- Свободнорадикальные реакции
- Электрофильные реакции
- Нуклеофильные реакции
По
принципу изменения состава молекул в органической химии выделяют 4 типа
реакций:
- Реакции присоединения
- Реакции
замещения
- Реакции
отщепления
- Реакции
перегруппировки
В
органических реакциях выделяют:
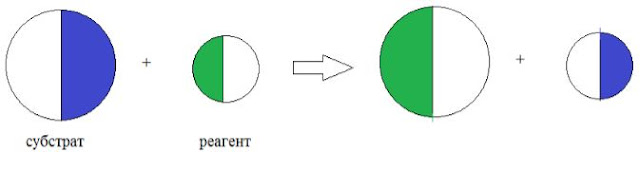
1.
Субстрат
– основное органическое вещество
2.
Реагент
– это вещество, молекула которого обладает более простым строением
ТИП РЕАКЦИИ ЗАМЕЩЕНИЯ
Это
реакции, в результате которых происходит замена атомов или групп атомов в
молекулах субстрата на другие атомы или группы атомов из реагента.
1. Вид: 1. реакция галогенирования (+Hal2)
1. Вид: 2. реакция нитрования (+HNO3)
1.
Вид: 3. реакция алкилирования (+R-Hal) галогенпроизводное углеводородов
ТИП ПРИСОЕДИНЕНИЕ
– это
реакции в результате которых атомы или группы атомов реагента присоединяются (добавляются)
к молекуле субстрата.
Реакции
присоединения характерны для органических веществ с кратными связями.
Присоединение реагента идет по месту разрыва пи-связи в молекуле субстрата
Вид: 1. гидрирование (+ Н2)
1. Вид: 2. галогенирование (+ Hal2)
1. Вид: 3. гидрогалогенирвоание ( + Н-Гал)
Правило
Марковникова — при
присоединении галогеноводородов или воды к несимметричным алкенам или алкинам
атом водорода из Галогенводорода присоединяется к наиболее
гидрогенизированному (гидрированному) углеродному атому (т.е. к атому С,
связанному с большим числом атомов Н), а атом галогена (или группа –ОН) – к
наименее гидрогенизированному.
Правило,
устанавливающее направление реакции присоединения галогеноводородов
(гидрогалогенирование) и воды (гидратация), сформулировал русский химик В.В.
Марковников в 1869 г.
Правило
Марковникова о присоединении по двойной связи объясняется смещением электронной
плотности в молекулах несимметричных алкенов.
Механизм присоединения по
правилу Марковникова
Электронная плотность в молекуле СН3-СН=СН2 до
вступления в реакцию распределена неравномерно. Это обусловлено тем, что
метильная группа СН3 за счет суммирования небольшой полярности
трех С-Н-связей является донором электронов, т.е. проявляет +I-эффект ссылка по отношению к соседним атомам углерода.

Это вызывает смещение подвижности π-электронов двойной связи в сторону более гидрогенизированного атома углерода и появлению на нем частичного отрицательного заряда (δ-).
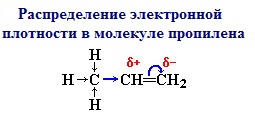
На другом, менее гидрогенизированном, атоме углерода возникает частичный положительный заряд (δ+). Поэтому атака электрофильной частицы Н+ происходит по более гидрогенизированному углеродному атому, а атом галогена или группа –ОН присоединяются к менее гидрогенизированному атому углерода.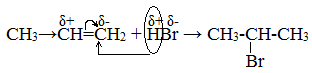
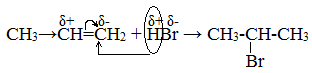
Например, гидробромирование бутена-2 и пропена:
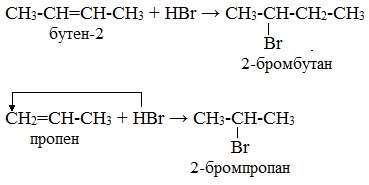
Бутен-2 является симметричным алкеном, оба углеродных атома относительно двойной связи совершенно равноценны. В результате первой реакции образуется один продукт – 2-бромбутан.
Пропен – несимметричный алкен. Один углеродный атом при двойной связи более гидрогенизирован, т.е. содержит большее число атомов водорода. Поэтому продуктом реакции является 2-бромпропан.
Присоединение воды к несимметричным алкенам также происходит по правилу Марковникова.
Например, гидратация пропена и бутена-1: 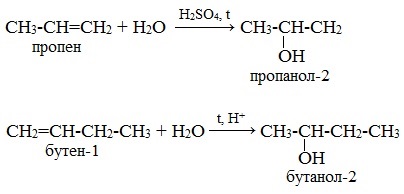
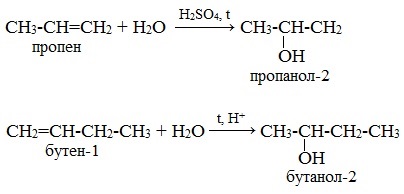
В результате гидратации пропена образуется пропанол-2, а не пропанол-1. А в результате гидратации бутена-1 – бутанол-2, а не бутанол-1.
Исключение из правила Марковникова.
Если же в алкене присутствует электроноакцепторный заместитель, т.е. группа, обладающая способностью оттягивать на себя электронную плотность, более стабильным может оказаться первичный катион и реакция пойдет против правила Марковникова, например гидрогалогенирование трифторпропена.
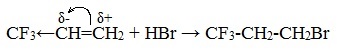
1. Вид: 4. реакция гидратации ( + Н2О)
См. пример выше.
ТИП ОТЩЕПЛЕНИЯ
- реакции
в результате которых от молекул исходного вещества отщепляется некоторые атомы
или группы атомов
1. Вид: 1. дегидрирования (- Н2)
СН3-СН3
→ кат. СН2=СН2 + Н2
1. Вид: 2. дегалогенирования ( - 2Гал)
1. Вид: 3. дегидрогалогенирования ( - Н Гал)
R-Hal + щелочь (NaOH, KOH)
|
|
Спиртовой
раствор
|
Водный
раствор
|
Реакция отщепления,
дегидрогалогенирование = образуются вещества с кратной связью
|
Реакция замещения
(атом Гал замещается на ОН группу из щелочи) = образуются спирты
|
Правило
Зайцева — отщепление
атома водорода в реакциях дегидрогалогенирования и дегидратации происходит
преимущественно от наименее гидрированного (гидрогенизированного)
атома углерода.
Эта закономерность была открыта в 1875 г. русским химиком А.М.
Зайцевым.
Дегидрогалогенирование алкилгалогенидов
(галогеналканов)
Реакция дегидрогалогенирования проходит при нагревании под
действием концентрированного спиртового раствора щелочи.
Использование водного раствора щелочи приводит
к образованию другого продукта реакции — спирта.
Дегидратация спиртов
Отщепление молекулы воды от вторичных и третичных спиртов
также идет по правилу Зайцева:
В тех
случаях, когда возможны 2 направления реакции, например:
дегидратация
идет преимущественно в направлении I, т.е. по правилу Зайцева – с
образованием более замещенного алкена.
1. Вид: 4. дегидратация ( - Н2О)
См выше.
ТИП РЕАКЦИИ ПОЛИМЕРИЗАЦИИ
- это
реакции, в ходе которых молекулы ОВ с небольшой молекулярной массой соединяются
друг с другом с образованием молекул органических веществ очень высокой
молекулярной массой – макромолекул, без
образования побочных продуктов.
Эта
реакция характерна для органических веществ с двойной связью, в которой
происходит разрыв π-связи:
Число
элементарных звеньев, повторяющихся в макромолекуле полимера, называется
степенью полимеризации (обозначается n).
ТИП РЕКАКЦИИ ПОЛИКОНДЕНСАЦИИ
- это
реакции, при которых происходит соединение двух и более молекул органических
веществ друг с другом, сопровождающиеся
отщеплением побочных продуктов.
Например,
реакция поликонденсации аминокислот
Обратите
внимание! В результате реакции поликонденсации образуется побочное вещество (в
данном случае вода). Это отличие от полимеризации.
6. ТИП РЕАКЦИИ ИЗОМЕРИЗАЦИИ
-
превращение одного изомера в другой. Виды смотрите в блоке IV
7. ТИП РЕАКЦИИ ОКИСЛЕНИЯ
- реакции,
в результате которых увеличивается степень окисления в
молекулах
органических веществ.
Выделают
следующие ВИДЫ:
1. Реакции
полного окисления (реакции горения)
А) ОВ
(углеводороды, кислородсодержащие вещества) + О2 → СО2 +
Н2О
В) ОВ
(азотсодержащие вещества) + О2 → СО2 + Н2О + N2
Например,
горение метана:
Реакция
неполного окисления (Окислительно-восстановительные реакции)
ОВ + [O] →
продукты окисления + продукты восстановления
В качестве
[O] окислителя могут выступать: слабые окислители (Ag2O, CuO,
Cu(OH)2) или
сильные окислители (KMnO4, K2Cr2O7)
Например
неполное окисление этанола: