В
зависимости от перекрывания электронных орбиталей, от расположения их в
пространстве молекулы, ковалентные связи делятся на: сигма (σ) и пи (π) связи:
|
Признак |
сигма (σ) |
пи (π) |
|
Вид перекрывания электронных
орбиталей |
Осевое перекрывание
вдоль линии связи, соединяющей ядра атомов |
Боковое
перекрывание p-электронных
орбиталей внешней связи. p-орбитали
расположены параллельно друг к другу |
|
Степень
перекрывания |
Значительная |
Незначительная |
|
Прочность
химической связи |
Очень прочная |
Слабая |
|
Способность к
химическим реакциям |
Низкая |
Высокая |
|
Положение
химической связи в пространстве молекулы |
В плоскости
молекулы |
Перпендикулярно
плоскости σ-связи |
|
Способность
вращения атомов относительно связи |
Свободное вращения |
Отсутствие
свободного вращения |
|
Орбитали
чувствующие в гибридизации |
Гибридные орбитали s и p |
p-p орбитали не чувствуют в
гибридизации |
I. Гибридизация
Это выравнивание или смещение орбиталей, находящихся на разных подуровнях, различной формы и энергии, в результате которого образуется новые равноценные гибридные орбитали одинаковой формы и энергии.
Объяснение этого факта впервые дал
американский химик Лайнус Полинг.
Ввиду относительной близости
значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать
между собой в ходе образования химической связи с электронами другого атома,
давая четыре новых равноценных гибридных электронных облака.
Атом С в органических соединениях может находиться в трех валентных состояниях. Этим валентным состояниям соответствуют различные типы гибридизации электронных орбиталей атома углерода.
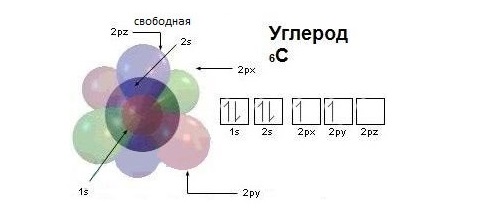
Модель атома углерода
Валентные электроны атома углерода располагаются на одной 2s-орбитали и двух 2р-орбиталях.
лектронная формула атома углерода в основном (стационарном) состоянии 1s22s22p2 указывает на то, что внешние электроны углерода неодинаковы: s-электрон имеет орбиталь в виде шара, р-электроны – в виде объемных восьмерок, расположенных под углом 900 друг к другу.

Если бы такое различие существовало, то у четырехвалентного углерода должна была бы наблюдаться неравноценностей связей. На самом же деле все четыре связи равноценны.
Да и сама четырехвалентность углерода не согласуется с приведенной выше электронной формулой: ведь валентность равна числу неспаренных внешних электронов, которых в приведенной формуле только два.
Объясняется это противоречие следующим образом. При образовании связей атом углерода переходит в возбужденное состояние, один из двух s-электронов перемещается на свободную 2р-орбиталь, приобретая электронную конфигурацию 1s22s12p3. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя p-электронами.
Переход атома углерода из основного состояния в возбужденное.
Число
образующихся гибридных орбиталей = числу исходных орбиталей, участвующих в
гибридизации.
Пример:
В зависимости от перекрывания орбиталей, от того сколько сига и пи-связей образует атом углерода, в нем происходит гиридизация орбиталей того или иного типа. В зависимости от типа гибридизации атомы углерода могут находиться в 3ех валентных состояниях
Количество
гибридных орбиталей = количеству сигма-связей; количество не гибридных p-орбиталей
= количеству пи-связей.
1ое валентное
состояние атома С или sp3
гибридизация
sр3-гибридизация - это смешение
одной 2s- и трех 2р-орбиталей и образование из них четырех новых одинаковых орбиталей, каждая из
которых на одну четверть сохраняет свойства s-орбитали и на три четверти —
свойства р-орбиталей.
Гибридные орбитали расположены в пространстве молекул под углом 1090 28` - форма молекул тетраэдер

Встречается в предельных органических веществах в одинарной сигма-связи.
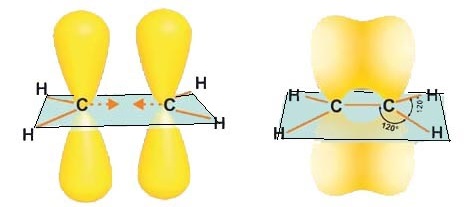
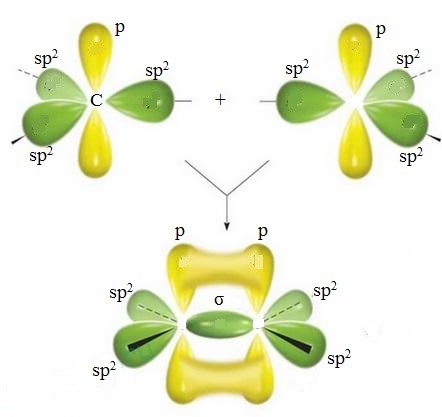
2ое ВАЛЕНТНОЕ СОСТОЯНИЕ ИЛИ SР2-ГИБРИДИЗАЦИИЯ
При sр2-гибридизациии участвуют
одна 2s- и две 2р-орбитали, образуя три sр2-гибридных облака. Эти sр2-орбитали расположены в одной плоскости под углом
1200 друг к другу
и направлены к вершинам треугольника. Не
гибридная p-орбиталь
расположена перпендикулярна плоскости гибридных орбиталей.
В непредельных углеводородах ряда этилена два атома углерода, находящиеся в состоянии sр2-гибридизации стоят всегда рядом. Между ними за счет обычного линейного перекрывания sр2-гибридных орбиталей возникает ковалентная связь (σ-связь).
Одна p-орбиталь остается негибридизованной и располагается
перпендикулярно плоскости sр–гибридных орбиталей. Верхняя половина р-орбитали находится над плоскостью, нижняя половина –
под плоскостью.
Вторая связь
также образуется между двумя углеродными атомами. Связь образуется в результате
бокового перекрывания краев негибридизованных 2рорбиталей и называется π-связью.
Перекрывание
негибридизованных 2р-орбиталей
Перекрывание негибридизованных 2р-орбиталей
|
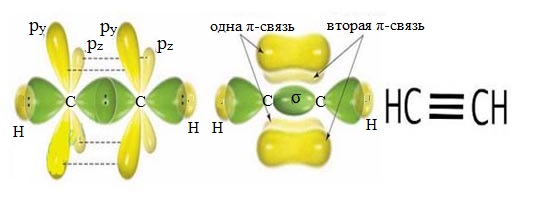
3ее ВАЛЕНТНОЕ
СОСТОЯНИЕ ИЛИ SР-ГИБРИДИЗАЦИЯ
2е
гибридные орбитали расположены в пространстве под углом 180 (линейно), а 2е
негибридные пи-орбитали взаимно перпендикулярны друг другу.
Встречается
в органических веществах с тройной связью
Образование
двух sр-гибридных орбиталей
Соединяясь,
два атома углерода в состоянии sр-гибридизации образуют одну σ-связь и две π-связи.
Одна σ-связь и две π-связи между атомами углерода вместе образуют тройную
связь. И наконец, происходит образование σ-связи между атомами водорода и
углерода. Молекула ацетилена имеет линейное строение, все четыре атома лежат на
одной прямой.

Электронные орбитали атомов углерода в молекуле ацетилена