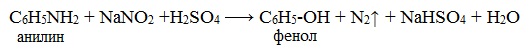Анилин – простейший ароматический амин, в котором атом азота аминогруппы непосредственно связан с углеродом бензольного кольца.
Анилин (фениламин, аминобензол) С6H5NH2 – важнейший представитель первичных ароматических аминов.

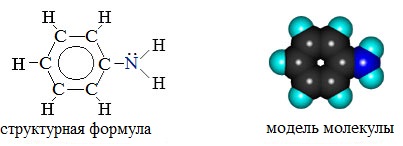

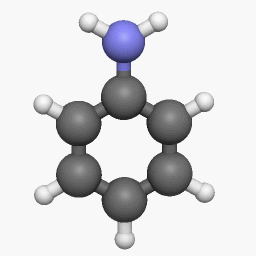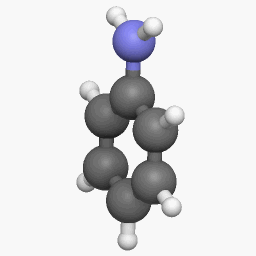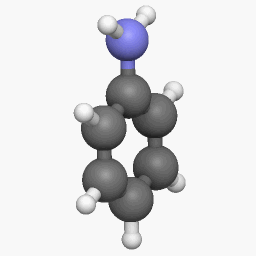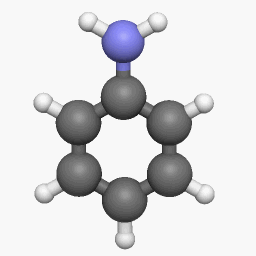
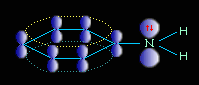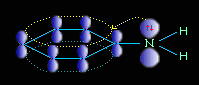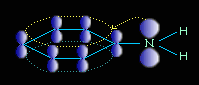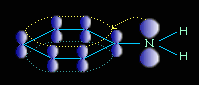
Электронное строение молекулы анилина
Строение молекулы анилина во многом похоже на строение молекулы фенола. На свойства анилина оказывает влияние бензольное кольцо.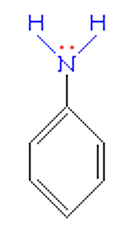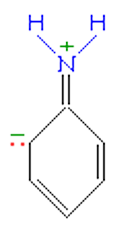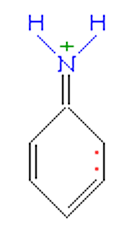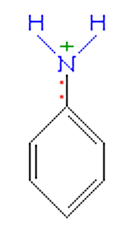
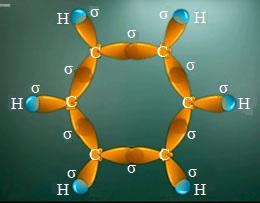
Бензольное кольцо состоит из атомов углерода, находящихся в состоянии sp2-гибридизации. Все атомы и связи между ними расположены в одной плоскости. Связи образованы гибридизированными орбиталями.
Перпендикулярно этой плоскости находятся негибридные р-орбитали.
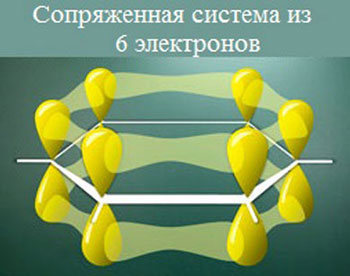
Они образуют сопряженную систему из шести электронов (π-электронное облако).
Электроны сопряженной системы делокализованы по всей молекуле, они как бы связывают все атомы углерода между собой, что обеспечивает прочность бензольного кольца.
В молекуле анилина с одним из атомов углерода бензольного кольца соединен атом азота.
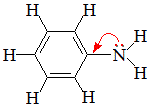
Неподеленная электронная пара атома азота взаимодействует с p-электронной системой бензольного кольца. Электронная пара атома азота втягивается в бензольное кольцо, в результате этого на атоме азота уменьшается электронная плотность и появляется частичный положительный заряд.
Основные свойства аминогруппы уменьшаются, слабее связывается протон (Н+). Поэтому анилин является слабым донором электронной пары.
В бензольном кольце, напротив, электронная плотность увеличивается, причем наиболее сильно в орто- и пара- положениях. Аминогруппа является ориентантом I рода (электродонором).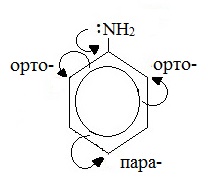
Такое смещение электронной плотности по цепи p-связей называется мезомерным эффектом. Аминогруппа проявляет положительный мезомерный эффект (+М). В структурной формуле его изображают изогнутой стрелкой.
Анилин – более слабое основание, чем аммиак и алифатические амины.
Влияние аминогруппы: атомы водорода в орто- и пара- положениях бензольного ядра замещаются легче, чем в бензоле.
Влияние бензольного кольца: основные свойства у анилина слабее, чем у алкиламинов (алифатических аминов).
Смещение электронов в сторону сопряженной системы ослабляет основные свойства анилина.
Физические свойства
Анилин представляет собой бесцветную прозрачную маслянистую жидкость с характерным запахом (tкип.= 1840С, t пл.= -60С), малорастворим в воде, тяжелее воды. Хорошо растворяется в спирте, эфире и бензоле. На воздухе быстро окисляется и приобретает желто-коричневую окраску. Смешивая анилин с водой и, энергично встряхивая, получают эмульсию анилина. Анилин ядовит!
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях: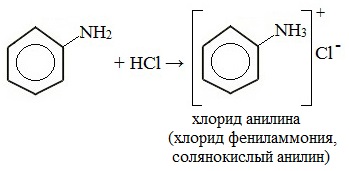
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
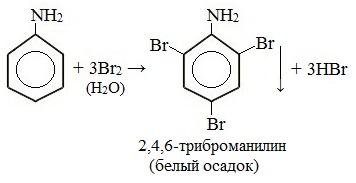
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
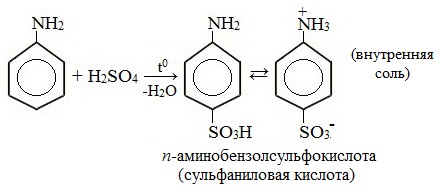
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
Видеоопыт «Бромирование анилина»
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca-(Cl)-OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.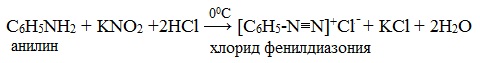
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Получение анилина
Впервые анилин
был получен в 1826 году при перегонке индиго с известью
немецким химиком О. Унфердорбеном и назвал его «кристалликом».
В
1834 году Ф. Ф. Pyнгe обнаружил анилин в каменноугольной смоле и назвал его
«кианолом».
В
1841 году Ю.Ф. Фрицше получил анилин нагреванием индиго с раствором едкого кали
KOH и назвал его «анилином».
В
1842 году Н.Н. Зинин получил анилин восстановлением нитробензола сульфидом
аммония и назвал его «бензидамом».
В
1843 году А. В. Гофман установил идентичность всех перечисленных соединений.
Восстановление нитросоединений (реакция Зинина)
Основной способ получения анилина – восстановление нитробензола.
Анилин и другие первичные ароматические амины получают с помощью рtакции, открытой русским химиком Н.Н. Зининым. В качестве восстановителя Н.Н. Зинин применял сульфид аммония:
Впоследствии в качестве восстановителя стали применять водород.
Промышленный способ
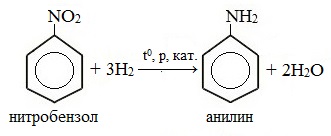
1. Каталитическое восстановление нитробензола (восстановление нитробензола молекулярным водородом)
В настоящее время этот способ восстановления нитробензола с целью получения анилина в промышленности является основным.
Смесь паров нитробензола и водорода пропускают над катализатором при температуре 3000С и повышенном давлении:
Лабораторный способ
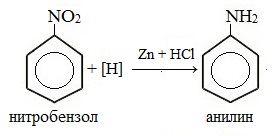
1. Восстановление нитробензола атомарным водородом
В лаборатории для этой цели используют цинк в кислой среде:
Восстановителем в этой реакции является атомарный водород, который получается в момент его выделения.
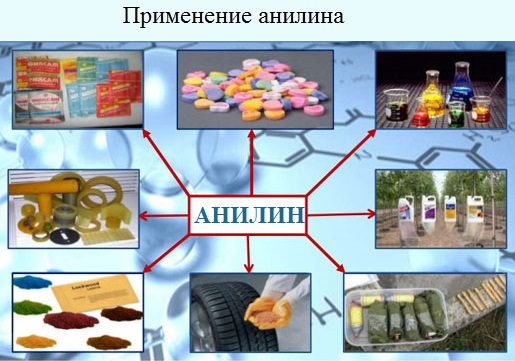
Применение анилина
Используется
в производстве лекарственных средств (сульфаниламидные препараты), смол, лаков,
духов, кремов для обуви, фотографических химикалий, взрывчатых веществ,
гербицидов и фунгицидов.
Анилин находит применение в качестве вулканизатора каучука, антиоксиданта и антиозонового средства.